Cara
Menggunakan Aplikasi Gchempaint
GChemPaint adalah editor untuk struktur kimia 2D
dengan kelipatan Dokumen antar muka. Molekul ditarik dapat dicari di NIST
Webbook dan PubChem. GchemPaint dapat digunakan untuk menggambar struktur kimia
dengan 2D yang dapat memudahkan pengguna untuk menganalisa struktur yang ada.
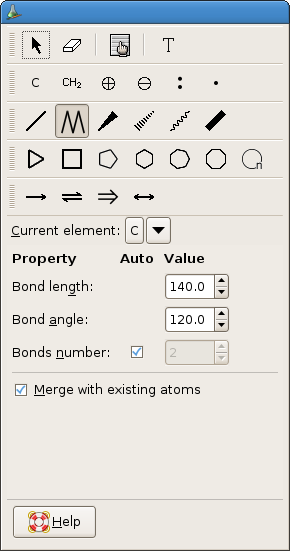
Penggunaan GChemPaint sangatlah mudah. Pengguna
tinggal mengklik ikon aplikasi pada pojok kiri atas kemudian mengklik menu
science dan mencari menu GChemPaint. Atau jika pengguna ingin mendapatkan
informasi berkaitan dengan GChemPaint dapat melalui menu Synaptic atau terminal
pada applications.
Cara penggunaan GChemPaint adalah:
1.
Pilih menu GChemPaint pada menu Science
2.
Penggunaan GchemPaint sangatlah mudah, pengguna
tinggal memilih gambar yang diinginkan dan menggambarnya pada kanvas yang ada
dengan cara meng-drag and drop gambar dan mengatur tampilan gambar agar sesuai
dengan yang diinginkan. Seperti jika kita ingin menggambar sebuah molekul
kolesterol sebagai berikut
3.
Aplikasi ini juga dilengkapi dengan unsur-unsur lain
selain unsur C dalam SPU, sehingga memudahkan kita menggambar apapun yang
diinginkan, seperti pada mesomeri benzena
4.
Atau jika pengguna ingin memilih struktur lain yang
diinginkan, contohnya jika pengguna memilih reaksi retrosintesis, maka gambar
yang ditampilkan akan seperti dibawah ini
5.
Penambahan lain adalah jika kita ingin menggambar
aplikasi lain, tool box yang ada dalam GChemPaint sangatlah beragam seperti
gambar dibawah ini,
atau dengan variasi semua alat menjadi
Cara menginstal GChemPaint dapat digunakan 2 cara,
yaitu dengan melalui Terminal dan melalui Synaptic:
1.
Penginstalan GChemPaint melalui terminal dapat
dilakukan dengan arahan sudo apt-get update [Enter]
2.
Setelah masuk pada admin pengguna, dapat mengetik sudo
apt-get install GChemPaint [Enter]
3. Selalu
ingat untuk menghubungkan pada internet / LAN jika akan menginstal aplikasi
pada Linux
4. Jadilah
aplikasi GChemPaint menjadi milik anda
Penginstalan pada Synaptic dapat dilakukan dengan
memilih menu Synaptic Package Manager atau menu Synaptic pada Desktop
- Cari program GChemPaint pada menu search
- Pada menu program GChemPaint, jika belum berwarna hijau, maka GChemPaint anda belum aktif, untuk itu harus diaktifkan dengan cara memilih menu mark all upgrades untuk menginstal semua aplikasi didalam GChemPaint.
- Lalu pilih menu apply untuk menginstal program
- Tunggu sampai file semua terinstal
- Program GChemPaint telah menjadi milik anda.
Terima kasih dan selamat mencoba :)